
Seit gut zwei Jahren ist sie in aller Munde: Die Abnehmspritze. Medikamente, die zur Behandlung von Diabetes gedacht waren, sollen Menschen innerhalb kürzester Zeit zu einem enormen Gewichtsverlust verhelfen. Doch was ist an diesen Versprechungen dran? Funktioniert „die Abnehmspritze“ wirklich? Wo ist der Haken? Reden wir drüber.
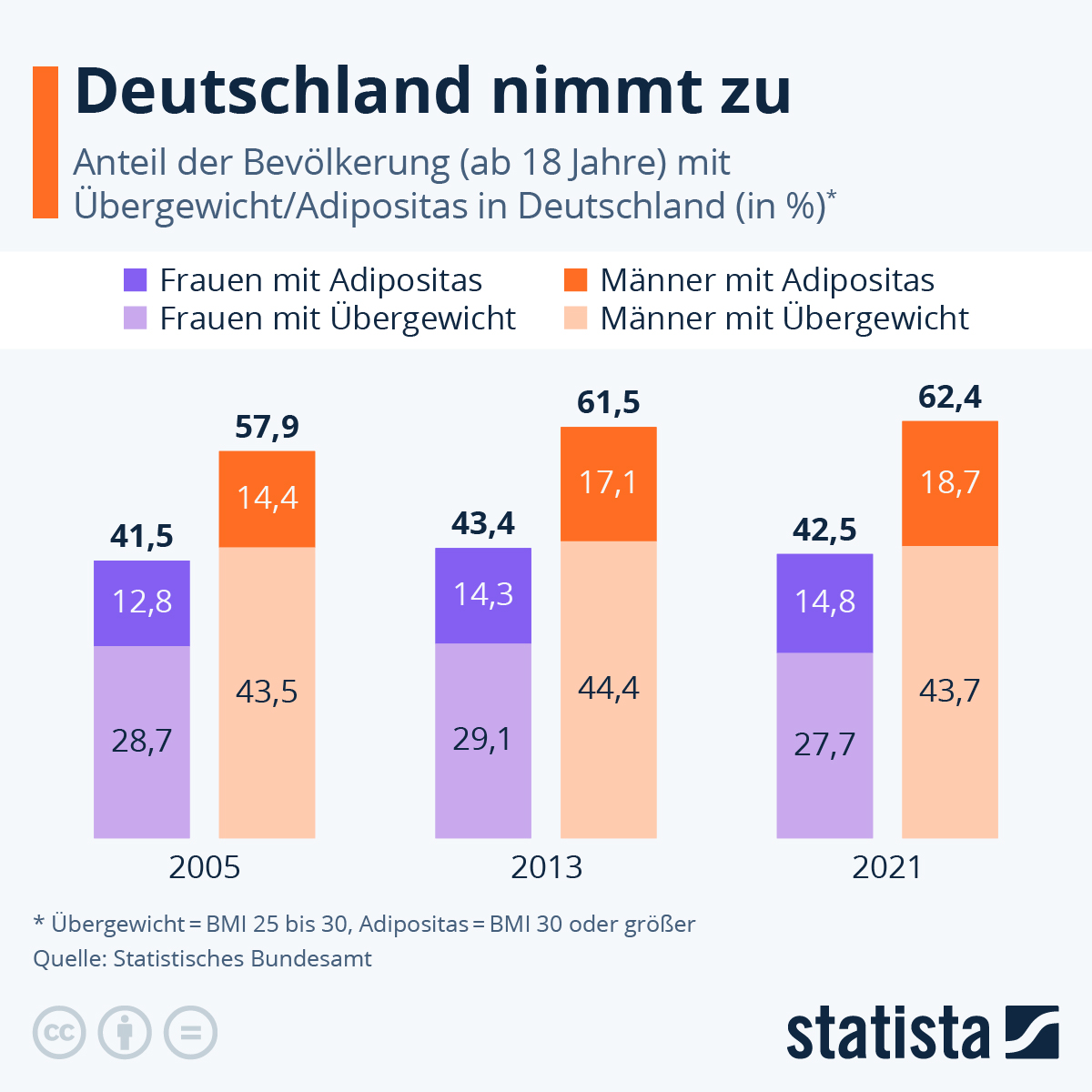
Laut der aktuellen Gesundheitsmonitoring-Studie des RKI sind in Deutschland 27,6% der Frauen und 41,3% der Männer Übergewichtig. Zusätzlich dazu sind in beiden Gruppen etwa 19% der Befragten Adipös. Das macht 46,6% übergewichtige Frauen und 60,1% übergewichtige Männer in Deutschland (ab jetzt fassen wir Übergewicht und Adipositas zwecks Lesbarkeit zusammen).
Während in der Gruppe der 18–29-Jährigen nur rund jede vierte Frau und jeder dritte Mann übergewichtig sind, sind es in der Gruppe der 30-44-Jährigen bereits fast jede zweite Frau und mehr als jeder zweite Mann. In der Gruppe der 45-64-Jährigen, sowie der über 65-Jährigen sind die Hälfte der Frauen, sowie zwei Drittel der Männer übergewichtig.
Auch unter Kindern und Jugendlichen zwischen 3 und 17 Jahren sind Übergewicht und Adipositas mit 15%, bzw. 5% verbreitet. Übergewicht ist also ein Problem aller Altersklassen, wobei zu sehen ist, dass die Prävalenz mit dem Alter zunimmt.
 Mehr Infografiken finden Sie bei Statista
Mehr Infografiken finden Sie bei Statista
Damit ist Übergewicht auch ein massiver Kostenfaktor im Gesundheitssystem. Aber wie massiv? Es entstehen sowohl direkte Kosten durch die Behandlung, als auch indirekte Kosten durch den Ausfall von Arbeitskraft, oder einem zu frühen Tod. Diese Gesamtkosten sind schwer zu beziffern. Die Uni Hamburg hat 2016 jährliche Kosten von bis zu 63 Milliarden Euro berechnet, eine Übersichtsarbeit aus 2018 kommt auf insgesamt 45 Milliarden und die World Obesity Federation beziffert die Kosten auf etwa 34 Milliarden. Wir reden also von Milliardenbeträgen, die jährlich eingespart werden könnten, wenn wir Übergewicht reduzieren.
Hinter all diesen Kostenfaktoren stecken aber echte Menschen. Adipositas verringert die Lebensdauer je nach Schwere um 2-10 Jahre, erhöht das Krebsrisiko z.B. für Bauchspeicheldrüsen-, Speiseröhren-, oder Darmkrebs, sowie das Risiko für koronare Herzkrankheiten und Schlaganfälle. All diese Risikofaktoren sind bei Adipositas am stärksten ausgeprägt, zeigen sich aber auch bereits bei übergewichtigen Menschen deutlich. [1]
Ebenfalls steigt durch Übergewicht das Risiko, an Typ-2-Diabetes zu erkranken. Aber wieso?
Was ist Diabetes und wofür brauchen wir Insulin? [2]
Zucker ist wohl der bedeutendste Energielieferant im menschlichen Körper. Aus diesem Grund hat sich ein ausgeklügeltes System etabliert, das die Konzentration von Zucker im Körper konstant halten soll. Dieses System basiert (stark vereinfacht) auf zwei Hormonen: Dem Insulin und seinem Gegenspieler, dem Glukagon.
Nach der Nahrungsaufnahme liegen im Körper viele Nährstoffe vor, unter anderem auch Zucker. Dieser wird mit dem Blut durch den Körper transportiert. Auch in das Pankreas, die Bauchspeicheldrüse. Dort befinden sich die sogenannten Langerhans-Inseln, benannt nach ihrem Entdecker, dem damaligen Medizinstudenten Paul Langerhans. In diesen Inseln befinden sich die Beta-Zellen, die bei einem erhöhten Zuckeraufkommen im Körper mit der Ausschüttung des Insulins beginnen.
Das Insulin findet seinen Weg zu einer Vielzahl von Körperzellen. Wir betrachten eine gewöhnliche Muskelzelle:
An Rezeptoren auf der Zelloberfläche angedockt, wird das Insulin ins Zellinnere aufgenommen, wo es eine Vielzahl von Reaktionen in Gang setzt. So befinden sich im Zellinneren Zuckerrezeptoren, die dort verschnürt und inaktiviert sind. Das Insulin signalisiert diesen, den Weg an die Zelloberfläche anzutreten, um den Zucker aus dem Blut ins Zellinnere aufnehmen zu können. Diese sogenannten GLUT4-Rezeptoren (Glukose Transporter 4) sind zwingend auf die Aktivierung durch Insulin angewiesen, während Organe wie das Pankreas oder die Leber Zucker auch ohne Anwesenheit von Insulin aufnehmen können. Das Insulin stimuliert also die Aufnahme von Zucker in die Zelle und senkt so die Menge an Zucker im Blut.
Wenn dem Körper viel Zucker zur Verfügung steht, ist ein Abbau der Zuckervorräte in den Zellen nicht mehr nötig, weshalb Insulin diesen Abbau hemmt und gleichzeitig die Synthese von Glykogen steigert. Glykogen bezeichnet einen Zusammenschluss von Zuckermolekülen zu einem großen Komplex, in dem der Zucker gespeichert vorliegt, bis er benötigt wird. Besonders große Glykogenspeicher befinden sich in der Leber, wo eine der Hauptanlaufstellen des Glukagons liegt. Denn in den Phasen zwischen den Mahlzeiten, wenn der Großteil der Nährstoffe im Organismus verteilt wurde, beginnt der Körper damit, die Speicher zu leeren, aus dem gespeicherten Zucker Energie zu gewinnen und so die Zeit bis zur nächsten Mahlzeit zu überbrücken. Gesteuert wird dies vom eben erwähnten Glukagon.
Zumindest gilt dies für den gesunden Körper.
In einigen Menschen ist die Funktion des Pankreas gestört und produziert kein Insulin mehr. Der häufigste Auslöser ist eine Autoimmunreaktion, welche die insulinproduzierenden Zellen zerstört. Diese Krankheit ist als Typ-1-Diabetes bekannt, tritt schon früh im Kindesalter auf und verlangt eine lebenslange Therapie mit Insulin.
Es gibt aber noch ein weiteres Krankheitsbild, das nicht mit einer gestörten Insulinproduktion, sondern mit einer gestörten Insulinaufnahme einhergeht.
Denn dummerweise ist Zucker nicht der einzige Energieträger, den der Körper verstoffwechseln kann. Fett ist ein anderer. Für gewöhnlich speichert der Körper das Fett in den Fettzellen, den Adipozyten, die quer durch den Körper verteilt sind. Wird dem Körper das Fett aber schneller oder in größeren Mengen zugeführt als es in den Fettzellen gespeichert werden kann, lagert sich das Fett auch in anderen Zelltypen ein. Bleiben wir beispielhaft bei den Muskelzellen, wo die Mitochondrien versuchen, das Fett zu verstoffwechseln. Bei starkem Übergewicht, Bewegungsmangel oder einem durch das Alter verlangsamten Metabolismus kommen die Mitochondrien mit dem Stoffwechsel nicht hinterher und es lagern sich Fettsäuren in der Zelle ein, die wiederum Enzyme aktivieren, die das Insulinsignal blockieren. Vereinfacht gesagt: Warum sollte eine Zelle Zucker aufnehmen, wenn doch schon mehr Fett vorhanden ist, als verstoffwechselt werden kann?
Zeigt das Insulin keine Wirkung auf die Muskelzelle, versucht das Pankreas diesen Umstand zu beheben, indem noch mehr Insulin produziert wird. Das Problem? Insulin wird produziert, indem der Vorläufer, das Proinsulin, vom endoplasmatischen Retikulum zu Insulin gefaltet wird. Steigt die Menge an Proinsulin kommt das endoplasmatische Retikulum irgendwann mit der Faltung nicht mehr nach. Es sammeln sich nicht- oder falsch gefaltete Proinsuline in der Zelle an, was deren Schutz- und Reparaturmechanismen auf den Plan ruft. Die Insulinproduktion wird runtergefahren, um die Zunahme von falsch gefaltetem Präinsulin zu stoppen, und die Zelle von diesem zu säubern. Das setzt die Zelle unter Stress. Bleibt dieser Stress, z.B. durch jahrelanges Übergewicht bestehen, kann es dazu kommen, dass der programmierte Zelltod, die Apoptose ausgelöst wird. Die Langerhans-Inseln im Pankreas werden zerstört, der Körper produziert weniger Insulin und ist irgendwann ebenfalls auf die Einnahme von Insulin angewiesen.
Diese Form des Diabetes, der durch Übergewicht oder einen reduzierten Metabolismus ausgelöst wird, bezeichnet man als Typ-2-Diabetes. Bevor es zu Schädigungen im Pankreas kommt, lässt sich diese Krankheit häufig erfolgreich bekämpfen, indem Patienten eine strikte Diät und ein ausreichendes Sportprogramm verschrieben wird.
Bei einigen Patienten ist dies aber nicht möglich. Besonders wenn gesundheitliche Gründe dagegensprechen, der Diabetes schon länger existiert, der Patient nicht bereit ist, die Ernährungsumstellung mitzumachen oder diese keinen ausreichenden Effekt zeigt. In solchen Fällen können Medikamente die Insulinausschüttung steigern und gleichzeitig die Kalorienaufnahme reduzieren, was beim Abnehmen hilft.
Von der Diabetestherapie zur Abnehmspritze
Um den Typ-2-Diabetes zu behandeln, werden sogenannte GLP-1-Agonisten verwendet. GLP steht für Glucagon-like Peptide (Glukagon ist das Hormon, das für die Verstoffwechslung von Zucker aus den Speichern zuständig ist) und ein Agonist ist ein Molekül, das an einen Rezeptor bindet und dort eine Reaktion verursacht.
Diese GLP-1-Agonisten binden an die gleichnamigen GLP-1-Rezeptoren, die auf vielen Organen des Körpers vorkommen. Zum Beispiel auf Pankreas, Gehirn, Leber und Magen.
Im Körper kommt GLP-1 ganz natürlich vor. Nehmen wir Nahrung auf, wird in Darmzellen das GLP-1 freigesetzt und bindet an die verschiedenen Rezeptoren quer durch den Körper. Im Gehirn bindet es an die Area postrema und löst so ein Sättigungsgefühl aus. Im Pankreas steigert es die Produktion von Insulin und die Zunahme an Betazellen. Im Magen verlangsamt es die Magenentleerung, was das Hungergefühl verzögert. Und allgemein reguliert es die Aktivität des Glukagons herunter, was die Freisetzung von Zucker im Körper weiter verlangsamt.
Das Problem ist nur die kurze Halbwertszeit des GLP-1. Im Körper wird es innerhalb weniger Minuten abgebaut. Zugelassene GLP-1-Agonisten wie Liraglutid oder Semaglutid (beides Novo Nordisk) enthalten GLP-1, das so modifiziert ist, dass es im Körper länger vorliegt, sodass die Patienten z.B. bei Semaglutid nur eine Injektion pro Woche benötigen, um ihre Zuckerlevel im Körper zu kontrollieren.
Und während man die Wirkung dieser Medikamente untersuchte, fand man heraus, dass die Patienten teilweise immens an Gewicht verloren. Man ging dieser Idee nach und fand erstaunliches:
In der SCALE-Studie hat man den Effekt von Liraglutid auf den Gewichtsverlust getestet. Einmal täglich erhielten die Probanden eine Injektion mit 3 mg des Wirkstoffes und nach 56 Wochen zeigte sich in der Wirkstoffgruppe eine Gewichtsreduktion um 8%, verglichen mit der Placebogruppe, die im gleichen Zeitraum nur 2,6% abnahm.
Noch deutlicher zeigten sich die Effekte in der STEP-Studie, in der Semaglutid untersucht wurde. Hier wurden einmal wöchentlich 2,4 mg des Wirkstoffes injiziert und nach 68 Wochen wurde bei den Probanden eine Gewichtsreduktion von 15% festgestellt, während es in der Placebogruppe nur 2,4% waren.
Dass diese Medikamente beim Abnehmen helfen, zeigt sich auch darin, dass die Patienten, die vom Wirkstoff auf das Placebo umstiegen, schnell wieder an Gewicht zulegten. Die Gewichtsreduktion war also tatsächlich medikamentös bedingt. Diese Ergebnisse zeigen aber auch, dass ohne einen nachhaltigen Lebenswandel keine langfristige Besserung zu erwarten ist.
Die Jagd auf das nächste Medikament
Kein Wunder also, dass viele andere Unternehmen die Erfolge von Novo Nordisk kopieren wollen. Moment, sagte ich „viele“? Ich meinte natürlich „fast jedes Pharmaunternehmen“. Eine kleine Übersicht gefällig? (Und von den Unternehmen, die bereits vor Beginn des großen Abnehm-Hypes ihre Medikamente für Typ-2-Diabetes auf den Markt gebracht haben, reden wir gar nicht erst.)
Pfizers Einstieg in den GLP-Markt hat sich als schwierig erwiesen, nachdem in der Phase-2-Studie ihres Kandidaten Danuglipron die Hälfte der Teilnehmer aufgrund von Nebenwirkungen wie Übelkeit und Erbrechen ausgestiegen sind. Eli Lilliys Medikament Zepbound fährt währenddessen Rekordgewinne ein, AstraZeneca investiert 185 Millionen Dollar Hoffnung in ein chinesisches Medikament und Boehringer Ingelheim ist ebenfalls fleißig am entwickeln eines eigenen Wirkstoffes. Ob Amgen im Wettlauf um den neuen GLP-Blockbuster dabei ist, wird sich wohl erst in den Phase-II-Studien zeigen, denn Phase I sah nicht restlos überzeugend aus.
Aber die Forschung geht weit über die Frage hinaus, wie viel Gewicht man mit GLP-1-Agonisten verlieren kann. In verschiedenen Studien zeigen sich Anzeichen potenzieller Einflüsse auf diverse Krankheiten. Diese reichen von Blutdrucksenkung, über entzündungshemmende Wirkungen, der Therapie von Suchterkrankungen, bis zur Blockade des Tumorwachstums bei Prostatakrebs. Welche dieser Funde sich in der Klinik bestätigen und zu wirksamen Medikamenten führen, wird die Zeit zeigen.
Aber selbst wenn sich herausstellen sollte, dass GLP-1-Agonisten „nur“ zur Behandlung von Diabetes und schnellem Gewichtsverlust taugen, so hat das plötzliche Interesse an diesem Wirkstoff vielleicht auch eine gute Seite für Typ-2-Diabetiker. Nicht nur dass sie von einer Vielzahl neuer Medikamente mit besserem Nebenwirkungsprofil profitieren können, die Entwicklung von GLP-1-Tabletten befindet sich in einem frühen Stadium. Und vielleicht weichen für diese Patienten damit eines Tages die regelmäßigen Injektionen einer morgendlichen Tablette.
Nur wer wird jetzt das Rennen um das nächste große Medikament gewinnen?
Vermutlich der Kandidat, der das geringste Nebenwirkungsprofil hat.
Die Nebenwirkungen
Wenn wir den Hype beiseitelassen, sehen wir, dass GLP-1-Agonisten Medikamente sind. Sie mögen einige beeindruckende Wirkungen haben, aber wenn etwas wirkt, hat es auch Nebenwirkungen. Und die müssen Beachtung finden.
Einige der eher sanften Nebenwirkungen sind Übelkeit, Kopfschmerzen und dergleichen, die sich im Laufe der Zeit häufig von allein bessern und wohl darauf zurückzuführen sind, dass sich der Körper an die neue Kalorienzufuhr anpassen muss.
Schwerwiegender ist da schon eine vermutete Nebenwirkung. Nämlich Schilddrüsenkrebs. Der Nachweis ist nicht in Stein gemeißelt, aber es gibt Hinweise, dass Diabetiker, die GLP-1-Agonisten länger als 1 Jahr einnehmen, ein etwa 60% höheres Risiko haben, an Schilddrüsenkrebs zu erkranken. Das heißt nicht, dass 60% der Patienten an Krebs erkrankt sind, sondern es bedeutet im Klartext folgendes:
Im Schnitt erkranken 5 von 100.000 Menschen an Schilddrüsenkrebs. Das entspricht einer Wahrscheinlichkeit von 0.005%. Steigt diese Wahrscheinlichkeit um 60%, dann erkranken nun 8 von 100.000 Menschen, was einer Wahrscheinlichkeit von 0,008% entspricht.
Inwiefern dieser Anstieg auf die Medikamente zurückzuführen ist, muss noch untersucht werden, denn Diabetes ist ohnehin mit einem bis zu 32% erhöhten Risiko für Schilddrüsenkrebs assoziiert. Zudem darf z.B. Semaglutid nicht verwendet werden, wenn der Patient eine familiäre Vorgeschichte von Schilddrüsenerkrankungen hat oder selbst erkrankt ist.
Zudem zeigt sich, dass 20-40% des verlorenen Gewichts kein Fett sind, sondern Muskeln. Das ist aber kein spezifisches Problem der Medikamente, denn dieser Verlust an Muskulatur liegt in derselben Größenordnung, die auch z.B. bei herkömmlichen Diäten zu erwarten wäre. Schleppt der Körper weniger Gewicht mit sich herum, werden auch weniger Muskeln benötigt und trotz des Verlusts an Muskelmasse zeigt sich bei Patienten am Ende ein gesünderes Verhältnis von Muskel- zu Fettgewebe. Die Gewichtsreduktion – egal auf welchem Weg – hat also insgesamt positive Auswirkungen.
Trotzdem müssen all diese Punkte dem Patienten bekannt sein, damit er eine informierte Entscheidung über seine Behandlung treffen und Maßnahmen zur Risikominimierung ergreifen kann. Wer eine familiäre Vorgeschichte mit Schilddrüsenerkrankungen hat, muss ohnehin auf andere Medikamente umsteigen und insbesondere ältere Patienten müssen zusätzlich zur Medikation körperlich aktiv bleiben.
Allgemein muss die Gabe von GLP-1-Agonisten mit einem Wandel des Lebensstils einhergehen. Wer nicht bereit ist, seine Nahrungsgewohnheiten zu ändern und sich zumindest ein bisschen zu bewegen, läuft sonst Gefahr, aus der wöchentlichen Injektion eine Dauermedikation zu machen, die ihn bis ans Lebensende begleitet.
Das Fazit
Letztendlich zeigt sich, dass GLP-1-Agonisten eine bahnbrechende Entdeckung nicht nur im Kampf gegen Diabetes, sondern auch im Kampf gegen Übergewicht sind. Trotzdem sind es Medikamente. Medikamente, die für Diabetiker lebensnotwendig sein können. Der Hype der vergangenen Monate hat zu massiven Engpässen bei der Verfügbarkeit von Wirkstoffen wie Semaglutid geführt. Diese Engpässe rufen auch Betrüger auf den Plan, die gepanschte Medikamente verkaufen.
Da in diesem Markt offensichtlich ein hoher Bedarf besteht, werden sich diese Probleme von allein lösen, wenn Pharmaunternehmen ihre Produktionskapazitäten ausbauen. Ob die Patienten es aber schaffen, die Medikation als ersten Schritt zu einem gesünderen Leben zu sehen, oder ob sie die Abnehmspritze nutzen, um so weiterzuleben wie bisher, das kann nur die Zeit zeigen.
[1] Der BMI, der die Grundlage der Einteilung in Übergewicht und Adipositas bildet, stellt im Allgemeinen nur eine unzureichende Maßeinheit für das Erkrankungsrisiko dar. Die Verteilung des Fettes am Körper spielt beispielsweise eine immense Rolle. Da es in diesem Beitrag aber um die Wirkung der „Abnehmspritzen“ gehen soll, genügt der unbestrittene Zusammenhang, dass ein erhöhtes Gewicht auch mit einem erhöhten Risiko für die genannten Erkrankungen einhergeht.
[2] Da der Energiestoffwechsel im Menschen schon Generationen von Studenten der Biowissenschaften in den Wahnsinn getrieben hat, halten wir es einfach, lassen viele Stoffwechselschritte außen vor und bezeichnen die Glukose der Einfachheit halber als Zucker, sowie Triacylglycerine und Fettsäuren als Fett.

